1차 작성: 2024.07.05
오늘은 "Escape from T-cell–targeting immunotherapies in acute myeloid leukemia"에 대해 내용을 정리하고자 합니다. 이 연구는 급성 골수성 백혈병(AML)에서 T세포를 표적으로 하는 면역요법의 저항 메커니즘을 탐구하는 중요한 리뷰 논문입니다.
출처: Blood (2024) 143 (26): 2689–2700. https://doi.org/10.1182/blood.2023019961
급성 골수성 백혈병(AML)은 분자적, 면역학적, 임상적으로 매우 다양한 특성을 지닌 질병입니다. 최근 치료 방법이 크게 발전했음에도 불구하고, 대부분의 환자들은 결국 재발하며 5년 생존율은 10%에 불과합니다.
이 리뷰에서는 다음과 같은 주요 내용을 다룹니다:
- AML의 면역 효과기 상태: T세포 고갈과 노화를 포함한 최근 연구 결과
- 종양 유발 신호 메커니즘: T세포 매개 사멸에 대한 AML 세포의 감수성 감소 원인
- 1형 및 2형 인터페론의 이중적 역할: 항종양 면역에서의 역할
- AML 종양 미세환경 조작: 면역관문억제제(CPI) 및 기타 T세포 면역요법에 대한 저항성 극복 방안
- 향후 전망: 고형 종양 분야의 최근 성공 사례를 바탕으로 한 AML 치료의 미래
이 연구는 단일 세포 및 공간 다중모달 기술의 발전으로 가능해진 AML 종양 미세환경에 대한 고차원적 이해를 바탕으로 합니다. 특히, IFN-γ 신호가 증가된 AML 하위그룹에서 CD123×CD3 이중특이성 분자와 CPI에 대한 임상적 이점이 관찰되었습니다.
이러한 지식은 AML 치료에서 면역요법의 효과를 높이고 저항성을 극복하는 새로운 전략 개발에 중요한 기반이 될 것입니다.


T세포 기능 장애의 다양한 형태
종양 미세환경에서는 노화된(senescent) T세포와 소진된(exhausted) T세포가 축적되어 항종양 기능이 저하됩니다. 이 두 가지 상태는 서로 다른 특성을 보입니다:
- 노화 T세포:
- CD27, CD28 같은 공동자극 분자 발현 감소
- CD57, KLRG1 고발현
- 세포 주기 정지 상태이지만 대사적으로 활성화
- 염증성 및 억제성 사이토카인 다량 생산
- 소진 T세포:
- 종양 항원에 의한 T세포 활성화의 지표
- 점진적이고 동적인 상태
- 바이러스 감염 시 지속적 항원 노출과 유사한 상태
소진 T세포 기능 장애의 스펙트럼
종양 내 T세포는 다양한 표현형을 보이며, 크게 기억 T세포와 소진 T세포로 구분할 수 있습니다. 이들은 기능이 점진적으로 저하되는 연속체 상에 존재합니다:
- 전구 소진 T세포 (TPEX) - progenitor exhausted T cell
- GZMK+ predysfunctional or “transitional” T cells (TEX)
- 초기에서 후기 기능장애 T세포
새로운 발견: 스트레스 반응 상태 (TSTR)
최근 연구에서 스트레스 관련 열 충격 유전자(HSP1A1, HSPA1B)의 특이적 발현으로 특징지어지는 새로운 세포 스트레스 상태(TSTR)가 발견되었습니다. 이 TSTR은 여러 고형 종양 면역치료 코호트에서 불량한 임상 결과를 예측했으며, 주요 병리학적 반응이 없는 환자의 종양에서 돌연변이 관련 네오항원 특이적 CD8+ T세포에 풍부했습니다.
향후 연구 방향
AML에서도 이와 유사한 TSTR 기능 상태의 예후 및/또는 예측적 관련성을 탐구하는 것이 매우 흥미로울 것입니다. 이러한 연구는 AML 및 기타 암에 대한 면역치료 전략을 개선하는 데 중요한 통찰을 제공할 수 있습니다.
주요 유전자 돌연변이와 TME

TP53 이외의 다른 유전자 돌연변이에 대한 내용은 아래와 같습니다.
- TET2 변이
- AML 환자의 10-30%에서 발견됩니다.
- 환자 유래 TET2 변이를 가진 쥐 모델에서, 골수성 변형으로의 진행이 inflammatory monocyte-like cells의 출현과 연관되어 있음이 밝혀졌습니다.
- 이러한 전사적 특징은 독립적으로 짧은 전체 생존율과 관련이 있습니다.
- IDH1/IDH2 변이
- IDH1 변이는 AML 환자의 6-10%에서 발견되며, 나쁜 예후와 연관됩니다.
- 이 변이는 T세포의 축적과 IFN-γ-inducible 케모카인의 발현을 제한합니다.
- IDH1/IDH2의 기능 획득 변이로 인해 생성되는 종양 대사산물 D-2-히드록시글루타레이트는 CD8+ T세포의 해당작용(glycolysis)을 변경시키고, 이들의 증식, 항종양 살해 능력, IFN-γ 유전자 프로그램의 발현을 가역적으로 억제합니다.
- 변이 IDH 특이적 억제제는 면역억제성 D-2-히드록시글루타레이트를 제거함으로써 면역치료의 효과를 향상시킬 수 있는 잠재력이 있습니다.
- 7번 염색체/7q 손실
- 조절 T세포와 CD8+ T세포의 높은 침윤, IFN-γ 경로 유전자의 하향 조절, 그리고 7번 염색체/7q가 온전한 AML 사례에 비해 나쁜 생존율과 연관됩니다.
- 9p21.3 결실
- 모든 암의 약 13%에서 발생하며, CDKN2A/B 종양 억제 유전자를 제거합니다.
- '차가운(cold)' 종양-면역 표현형을 나타내어 종양 침윤 림프구의 감소, 면역 세포 이동/활성화 감소, PD-L1 양성률 감소, 면역억제 신호의 활성화, 그리고 면역 관문 억제제에 대한 일차 내성을 유발합니다.
- 16개의 제1형 인터페론 유전자 클러스터를 포함하는 9p21.3 결실은 수지상 세포와 CD8+ T세포의 기능 장애, 고형 종양 전이의 탈억제, 그리고 면역치료 내성과 연관됩니다.
- 흥미롭게도, 이러한 제1형 인터페론 유전자의 동형접합 결실은 AML에서는 매우 드물어 1% 미만의 환자에서만 발견됩니다.
- KMT2A-MLLT3 융합
- t(9;11) 전좌에 의해 야기됩니다.
- 이 융합 유전자를 가진 AML이 면역유전학적으로 독특한 특성을 가지는지 여부는 향후 연구의 흥미로운 주제가 될 수 있습니다.

Type I/II IFN 신호
IFN의 역할
- 다양한 사이토카인 기능: IFN은 암 면역감시와 면역요법 반응에 중요한 역할을 하지만, 상황에 따라 종양 촉진 효과도 나타낼 수 있습니다.
IFN-γ 신호와 면역 체크포인트 억제제(CPI) 반응
- 유전자 변이: JAK1, JAK2, IFNGR1, IFNGR2, STAT1 등의 핵심 IFN-γ 신호 유전자 변이는 CPI 반응과 높은 연관성을 보임.
- 염증성 유전자 서명: 염증성 및 IFN-γ 유전자 서명은 모든 ELN2017 계층에서 예후가 좋지 않음을 시사.
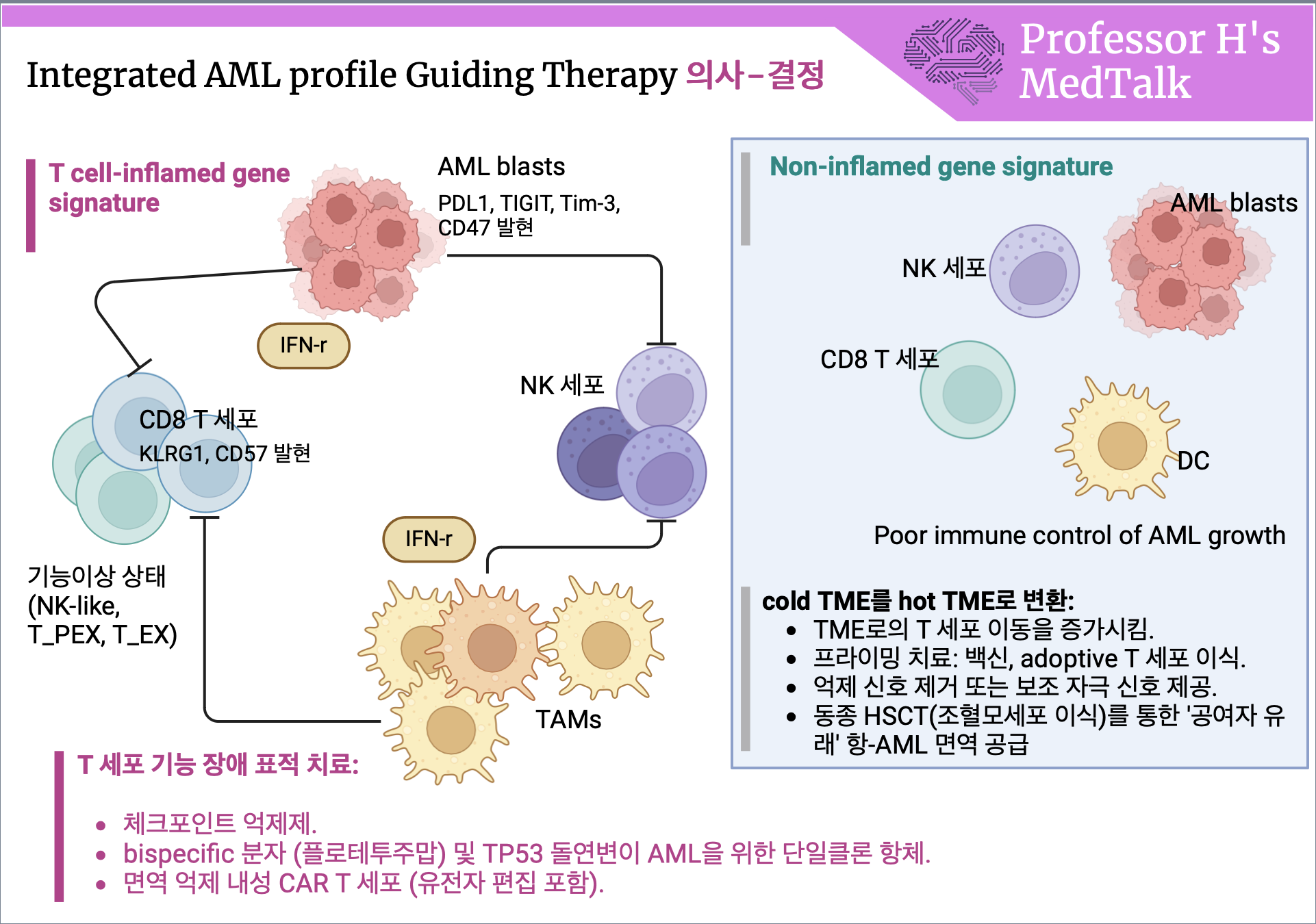
AML의 면역 상호작용과 임상적 가능성
T 세포 기능 상태와 AML 반응
현재 T 세포 기능 상태와 이들이 AML의 화학요법, 이중 특이성 분자, 면역관문 억제제(CPIs)에 미치는 영향에 대한 이해가 중요합니다. 면역 유전자 발현 분석(대량 및/또는 scRNA-seq)은 임상적으로 검증된 예후 인자(ELN 위험 범주, LSC17 점수, TP53, RUNX1, IDH1/2 및 TET2 돌연변이 상태)와 통합되어 AML 환자를 생존 확률이 크게 다른 하위 그룹으로 정확히 분류하는 것이 필요합니다.
IFN-γ 우세, 면역이 풍부한 TME 환자 : IFN-γ dominant gene signature
- 이러한 환자는 T 세포 기능 장애 상태를 타겟으로 하는 면역요법(예: T 세포 엔게이저, CPIs) 할당 가능
- TP53 변이가 있는 AML은 CD123을 타겟으로 하는 이중 특이성 분자에 반응을 보임
면역이 결핍된 "콜드" 프로필 환자 : non-inflamed gene signature
- TME로의 T 세포 이동을 증가시키거나 백신, adoptive T 세포 이식, 동종 조혈모세포 이식(HSCT)과 같은 초기 요법이 유익할 수 있음
IFN 신호 조절
- 타입 I과 타입 II IFN 신호:
- IFN 신호 조절은 CPIs 및 다른 T 세포 기반 면역요법에 대한 저항 극복에 중요할 수 있음
- 치료 전 종양 세포에서의 IFN-I 저반응성은 장기 생존과 상관관계가 있음
- 암 세포의 IFN-I 신호를 억제하면 면역 세포에서 IFN-II 신호가 증가하여 T 세포가 효과기 기능 상태로 확장됨
T세포 피로와 노화가 치료 반응에 미치는 영향
1. 화학요법의 영향
AML(급성 골수성 백혈병)의 표준 치료인 화학요법, 분자 표적 치료, 면역 요법에 대한 T세포 이상이 어떻게 영향을 미치는지 완전히 이해되지 않았습니다. 첫 번째 완전 관해(CR)가 5년 이상 지속된 환자들은 상대적으로 면역 억제가 덜한 종양 미세환경(TME)과 활성화 및 피로와 관련된 유전자 발현이 낮은 T세포를 가지고 있는 것으로 나타났습니다.
1.1 T/NK 세포의 변화
주요 scRNA-seq 연구에서는 AML 환자 중 일부에서 화학요법 후 T/NK 세포의 양적 결함, Treg 세포의 증가, 그리고 T/NK 세포의 우세한 상태를 보였습니다. 또 다른 고차원 유세포 분석 연구에서는 화학요법에 반응하는 환자와 반응하지 않는 환자 사이에서 CD8+ T 세포의 전사적 프로필이 다르며, 반응하는 환자 그룹은 공동 자극 분자의 발현 증가, 세포 사멸 및 억제 경로의 감소, 그리고 전반적으로 정상 패턴에 가까운 CD8+ 유전자 발현 시그니처로의 회복을 보여준다고 밝혔습니다.
1.2 면역 효과기 기능 장애
TP53 및 RUNX1 돌연변이가 있는 환자에서는 면역 효과기 기능 장애(IED)의 전사적 특징을 가진 NK-유사 CD8+ T 세포가 더 많이 발견되며, 이는 재발 없는 생존 및 전체 생존(OS)이 유의미하게 짧은 것과 관련이 있습니다. 이러한 CD8+CD57+KLRG1+ 노화 유사 T 세포는 anti-CD33/CD3 이중 특이성 T 세포 활성화 항체 구성으로 활성화될 때 자가 AML blast를 용해하는 능력이 저하되었습니다.
- T세포 클론 확장: 유도 화학요법에 완전 반응하는 환자에서는 GZMK+IL7R+CD8+ 타입의 TPEX가 클론적으로 확장되며, 이는 연장된 OS와 관련이 있습니다.
1.3 재발/불응성 AML과의 연관성
재발/불응성(R/R) AML에서 NK-유사(KLRG1+), 효과기 메모리(EM1), 세포독성 T 림프구(CTL11) 전사 프로필을 가진 T 세포가 더 많이 발견되며, 이는 새로 진단된 AML과 비교할 때 더 높은 비율을 보입니다. 이러한 T 세포 클러스터와 관련된 유전자 조절 네트워크 분석은 NFYB 및 STAT1 조절자의 높은 활성을 나타내며, 이는 type I IFN 생성과 관련이 있습니다. 이전 보고서와 일치하게, 치료 전 TCGA AML 사례에서 더 높은 CD8 유전자 점수는 더 나쁜 생존과 상관관계가 있습니다.
- 염증 위험 점수: 높은 염증 위험 점수는 adverse-risk 분자 특징, Treg 세포 및 GZMK+CD8+ T 세포의 확장, reduced EFS 및 OS, 그리고 myeloid-like phenotype과 연관이 있습니다. 이는 염증 프로그램이 AML blast에 의해 주도될 수 있음을 시사합니다.
2. T 세포 면역요법
여러 고형 종양에서 종양 미세환경(TME) 아형이 면역요법 효능과 상관관계가 있다는 것이 밝혀졌지만, AML에서의 면역요법 성공 또는 실패의 바이오마커에 대해서는 거의 알려져 있지 않습니다.
아자시티딘azacitidine과 니볼루맙nivolumab의 임상 시험에서는 전체 반응률이 33%로 나타났으며, 이는 과거 historical 대조군의 20%와 비교되는 수치입니다. 특히, 치료 전 골수에서 CD3+ 및 CD8+ T 세포 빈도가 높은 경우 전체 반응률이 유의하게 개선되었습니다. 이는 AML 진행 및 광범위한 화학요법 치료가 T 세포 기능 장애를 유발하여 CPIs에 대한 반응을 저하시킬 수 있음을 시사합니다. 무반응자에서는 RORγt와 inducible T-cell costimulator (ICOS)를 공동 발현하는 Th17-like T 세포가 치료 중에 확장되는 특징을 보였습니다.
핵심 요약: T 세포 면역요법에서 AML 환자의 반응률은 치료 전 T 세포 빈도와 연관이 있으며, T 세포 기능 장애는 면역요법의 반응에 부정적인 영향을 미칠 수 있습니다.
2.1 플로테투주맙 임상 시험 결과
최근 CP-MGD006-01 임상 시험에서 재발/불응성(R/R) AML 및 TP53 이상이 있는 환자 중 47%가 플로테투주맙flotetuzumab 면역요법에서 혜택을 보았습니다. 반응을 보인 환자들은 초기 종양 염증 시그니처, FOXP3 및 CD8 유전자 발현 점수가 유의하게 높았습니다. 이는 IFN-γ 주도의 TME를 반영합니다.
TP53 소실은 면역 체크포인트 및 효과기 T 세포 관련 유전자 발현 증가와 상관관계가 있으며, CPI 치료에 대한 개선된 반응과 연관이 있습니다. 반면, 췌장 종양에서의 TP53R172H 기능 획득 돌연변이는 면역 억제성 호중구의 모집을 촉진하여 면역요법 및 화학요법에 대한 저항성을 유발합니다.
핵심 요약: 플로테투주맙 면역요법은 TP53 이상이 있는 AML 환자에게 효과적일 수 있으며, TP53 소실은 CPI 치료 반응과 연관이 있습니다.
2.2 CTLA-4 억제와 AML 치료
조혈모세포 이식(HSCT) 후 재발한 AML 및 기타 혈액암에서 이필리무맙ipilimumab을 사용한 CTLA-4 억제는 약 3분의 1의 환자에게서 반응을 유도하였습니다. 조직 생검에서 CD8A 및 PRF1 발현 증가, 혈중 조절 T 세포 감소, 임상 반응과 관련된 T 세포 유인 케모카인의 증가가 관찰되었습니다.
ETCTN 9204 시험에서는 이필리무맙이 HSCT 후 재발한 AML의 regression을 유도할 수 있음을 시사하며, 이는 독성 CD8+ T 세포를 백혈병 부위로 모집하는 것으로 보입니다.
핵심 요약: CTLA-4 억제제 이필리무맙은 HSCT 후 재발한 AML 환자에게 효과적일 수 있으며, CD8+ T 세포의 모집과 관련이 있습니다.
2.3 펨브롤리주맙과 데시타빈의 효과
R/R AML에 대한 펨브롤리주맙pembrolizumab과 데시타빈decitabine의 첫 번째 임상 시험에서는 면역 관련 부작용을 겪은 환자들의 TCR 서열 및 면역 전사체의 변화를 확인했습니다. 클론 확장은 주로 CD8+ 효과기 메모리 T 세포에서 발생했으며, 이는 활성화/세포 독성 상태를 반영합니다.
다른 연구에서는 비반응자에서 TCR 레퍼토리 축소와 악성 세포의 chr7/7q 소실이 상관관계가 있는 것으로 나타났습니다. 특히, 치료 반응을 보인 환자는 mucosal-associated invariant T 세포(MAIT)의 확장을 보였습니다.
핵심 요약: 펨브롤리주맙과 데시타빈 치료는 R/R AML 환자에서 TCR 레퍼토리와 면역 전사체의 변화를 유발하며, 치료 반응은 TCR 레퍼토리 확장과 관련이 있습니다.
2.4 AML 줄기 세포 계층과 치료 반응
AML 아형에 따라 치료 반응, 생존율, 약물 감수성 프로파일이 달라지는 것으로 나타났습니다. 특히, 재발 환자 대부분에서 백혈병 줄기 및 전구 세포가 확장되었습니다. CPI 치료에 대한 반응을 개선하려면 NK 세포의 AML 타깃 인식을 증가시켜야 합니다[LSCs lack expression of NKG2D ligands, which is reversed by genetic or pharmacological inhibition of PARP1]. NK 세포 인식을 통해 CPI의 효능을 향상시킬 수 있는 방법이 제시되었습니다.
핵심 요약: AML 줄기 세포 계층은 치료 반응에 중요한 역할을 하며, NK 세포의 AML 타깃 인식을 개선하는 것이 CPI 치료의 효능을 높이는 데 필요합니다.
3. 키메라 항원 수용체(CAR) T 세포
3.1 CAR T 세포 치료의 개요
CAR T 세포는 합성 항원 결합 도메인과 추가적인 공동자극 도메인을 장착한 유전자 변형 자가 T 세포로, MHC 독립적인 표적 인식을 가능하게 합니다. 2011년, B 세포 악성 종양에서 발현되는 CD19를 표적으로 하는 2세대 CAR T 세포가 암 치료를 위한 설계된 T 세포 요법의 주요 패러다임으로 등장했습니다.
핵심 요약: CAR T 세포는 MHC에 의존하지 않고 표적을 인식할 수 있도록 유전자 변형된 자가 T 세포입니다.
3.2 AML에서의 CAR T 세포 치료의 도전과제
AML에서 CAR T 세포 치료는 이상적인 표적의 부족과 장기간 골수억제에 대한 우려 때문에 어려운 과제입니다. B7-H3와 같이 정상 골수 전구 세포 집단에서 유의미하게 발현되지 않는 AML 항원이 골수 독성을 최소화하기 위해 평가되고 있습니다. 전임상 AML 모델에서 최소한의 비표적 독성을 가진 CAR T 세포 치료의 후보 표적으로 colony-stimulating factor 1 receptor (CSF1R)와 CD86이 제시되었습니다.
핵심 요약: AML에서의 CAR T 세포 치료는 표적 항원의 부족과 골수독성 우려 때문에 어려움이 있지만, 새로운 후보 표적 (CSF1R, CD86)이 발견되고 있습니다.
3.3 CAR T 세포 치료에 대한 저항성
CAR T 세포 소진은 큰 B 세포 림프종 환자에서 종양 회피 메커니즘으로 제안되었습니다. CD19 CAR T 세포에 대한 초기 분자 반응 실패는 CD8+ T 세포 소진과 LAG3+TIM3+CAR+CD8+ T 세포의 높은 빈도와 관련이 있습니다. 만성적으로 자극받은 mesothelin-directed CD8+ CAR T 세포는 소진 마커를 상향조절하고 높은 수준의 NK 수용체와 체크포인트 분자를 가진 기능 장애 표현형을 획득합니다.
핵심 요약: CAR T 세포 소진은 치료 저항성의 주요 원인으로, 소진 마커의 발현 증가와 기능 장애를 초래합니다.
3.4 CAR T 세포 기능 향상 연구
주입 후 28일째 수집된 CAR T 세포에서 상향조절된 유전자는 부분적으로 LCMV에 감염된 쥐의 중간 및 말기 소진 T 세포에서 발현된 유전자와 중복됩니다. CRISPR–Cas9을 사용한 ID3 및 SOX4 전사 인자의 파괴는 dysfunctional NK-like T 세포의 빈도를 감소시키고 종양 살상 능력을 향상시켰습니다. 쥐에서 저메틸화제를 사용한 AML 세포의 전처리는 CD123 발현을 증가시키고 우수한 세포독성 활동을 가진 CTLA-4neg anti-CD123 CAR T세포를 확장시켰습니다. 이 연구는 에피제네틱 변형제를 CD123 표적 CAR T 세포와 결합하여 AML 치료에 사용할 수 있음을 시사합니다.
핵심 요약: 에피제네틱 변형제와 CD123 표적 CAR T 세포의 병용은 AML 치료의 효과를 향상시킬 수 있습니다.
4. 동종 조혈모세포 이식 후 재발하는 AML의 면역 환경
4.1 HSCT 후 AML 재발 치료
HSCT 후 재발한 AML의 치료는 여전히 해결해야할 숙제입니다. 추가 화학요법에 반응하는 환자 중 단지 20%만이 두 번째 HSCT나 화학요법 후 공여자 림프구 주입을 통해 장기 완화에 이르게 됩니다. 재발 시 AML blast는 낮거나 감지할 수 없는 MHC-II를 발현하여 면역 회피를 유리하게 합니다.
플로테투주맙은 IFN-γ의 국소 방출을 통해 AML 세포에서 MHC-II를 상향 조절하여 동종 반응성 T 세포를 재활성화할 수 있습니다. 억제 수용체(IRs) 및 기타 면역 관련 유전자는 화학요법 후 재발 환자보다 HSCT 후 재발 환자의 AML blast에서 더 높게 발현되어 있습니다. 이는 CPIs가 T 세포를 재활성화하고 이 환경에서도 유익한 항-AML 면역 반응을 회복할 가능성을 강조합니다.
핵심 요약: HSCT 후 재발한 AML에서 CPIs가 T 세포를 재활성화하고 면역 반응을 회복하는 데 잠재적인 효과가 있습니다.
4.2 T 세포 기능 장애 및 대사적 제약
오랜 임상 완화 후 HSCT 후 재발한 AML 환자의 TME에서는 기능적으로 손상되었지만 백혈병에 반응을 보이는 CD8+ T 세포가 CTLA-4와 TIM-3을 발현하며 TME내에 축적됩니다. T 세포의 소진된 표현형은 고용량의 IL-2에 노출되었을 때 부분적으로 회복되며, T 세포는 다기능성(IFN-γ와 TNF-α 분비)을 회복하지만 IL-2 생산 능력은 회복되지 않습니다.
종양 세포는 포도당 고갈과 TME에서 면역 억제 부산물인 젖산을 생성하여 T 세포에 대사적 제약을 가하는 것으로 밝혀졌습니다. HSCT 후 재발한 AML 환자의 혈액 T 세포는 질병 완화 시 수집된 표본과 비교하여 해당작용과 IFN-γ 생산이 감소합니다.
핵심 요약: 종양 세포는 대사적 제약을 통해 T 세포 기능을 손상시키며, 이는 특정 치료로 부분적으로 회복될 수 있습니다.
4.3 Sorafenib과 공여자 림프구 주입의 시너지 효과
FLT3-ITD+ AML 환자가 HSCT 후 재발한 경우, 소라페닙과 공여자 림프구 주입의 시너지 효과가 보고되었습니다. 완전 관해를 달성한 환자에서는 혈청 IL-15 및 IFN-γ 수준과 blast IL15 및 IRF7 메신저 RNA가 증가했습니다. 동시에 혈액 CD8+ T 세포의 대사 회복이 관찰되었습니다. 이 연구는 FLT3-ITD+ AML 재발 환자에서 소라페닙이 강력한 항-AML 효과를 촉진할 수 있음을 시사합니다.
핵심 요약: Sorafenib은 FLT3-ITD+ AML 재발 환자에서 강력한 항-AML 효과를 유도할 수 있습니다.
4. 4 기계 학습을 통한 새로운 연관성 발견
기계 학습 기반의 종단적, 짝지어진 BM 샘플 분석은 성인 환자의 재발 시점에서 면역 시냅스 형성에 관여하는 CD6의 과발현을 포함하여 염증 신호와 AML 진행 간의 새로운 연관성을 밝혀냈습니다[Transcriptomic analysis reveals proinflammatory signatures associated with acute myeloid leukemia progression].
핵심 요약: 기계 학습을 통해 염증 신호와 AML 진행 간의 새로운 연관성이 밝혀졌습니다.
정리 및 앞으로의 전망
면역요법의 맞춤형 접근
IFN-γ 우세, 면역이 풍부한 TME [ IFN-γ–dominant, immune-enriched ]를 가진 환자에게는 T 세포 기능 회복을 목표로 하는 면역요법, 예를 들어 T 세포 인게이저 및 CPIs가 유리할 수 있습니다. 반면, 면역이 고갈된 전사 프로파일을 가진 환자는 BM TME로의 T 세포 이동을 증가시키는 전략, 백신, adoptive T 세포 이식 및 동종 HSCT와 같은 다른 치료 전략의 혜택을 받을 수 있습니다. 면역학적 특징을 목표로 하는 면역요법, 예를 들어 1형(IFN-I) 및 2형(IFN-II) IFN 신호 및 CPIs와 분자 타겟 제제를 포함하는 조합 접근법을 탐구해야 합니다.
핵심 요약: 환자의 면역 프로파일에 따라 맞춤형 면역요법을 적용하여 T 세포 기능 회복을 목표로 하거나, T 세포 이동 증가와 같은 다른 전략을 사용할 수 있습니다.
CAR T 세포 치료의 도전과제
CAR T 세포 치료를 받은 AML 환자에서의 반응, 저항성 및 독성의 면역 상관관계를 식별하고 검증하는 것이 중요합니다. CAR T 세포의 소진과 노화를 방지하고, TME의 대사 장벽을 중화하는 전략을 고안해야 합니다. 화학요법이 T 세포 체크포인트의 발현을 감소시킨다는 관찰은 면역요법의 최적 시기에 대한 중요한 질문을 제기하며, CPI가 다중 약제 화학요법 및/또는 HSCT 이후보다 1차 치료로서 더 효과적일 수 있다는 추측을 낳습니다.
핵심 요약: CAR T 세포 치료의 효과를 높이기 위해서는 CAR T 세포의 소진과 노화를 방지하고, 최적의 면역요법 타이밍을 찾는 것이 중요합니다.
powered by chatGPT 4.0o, claude 3.5 sonnet
'의학' 카테고리의 다른 글
| AML 연구 데이터 소스: TCGA LAML, Beat AML 코호트, TARGET pediatric AML (0) | 2024.07.18 |
|---|---|
| 동종 이식 후 백혈병의 면역 회피 메커니즘과 맞춤형 치료법 (0) | 2024.07.06 |
| 긴급보고 - 한국 의료 시스템의 위기: 젊은 의사들의 대규모 사직과 그 배경 (0) | 2024.06.14 |
| "헌혈 혈액 내 #망상적혈구수 #reticulocyte와 수혈 중 동종 항체 생성과의 연관성" 규명-Hematologica, 2023.10 (0) | 2023.10.06 |
| "레날리도마이드, TP53 돌연변이 양성 골수성 종양 발생 위험 증가"-Blood 저널 2022 8월 (0) | 2023.10.05 |